Adanya susunan elektron yang khas pada subkulit 3d dan 4s menyebabkan unsur transisi periode keempat mempunyai sifat yang khas, yang berbeda dengan sifat keperiodikan pada logam-logam golongan utama (A).
Beberapa sifat umum unsur transisi :
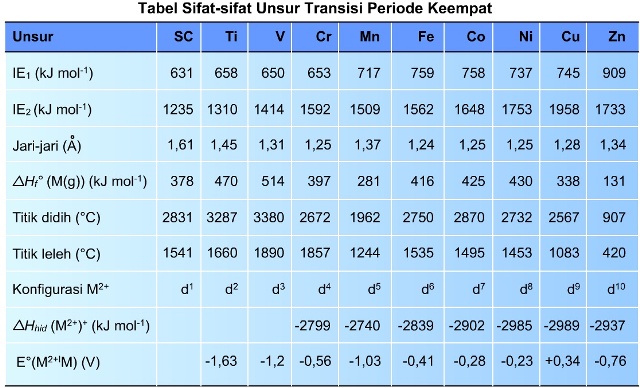
Dari tabel sifat keperiodikan di atas, kita dapat simpulkan beberapa sifat atomik dan sifat fisis dari logam transisi :
- Jari-jari atom berkurang dari Sc ke Zn, hal ini berkaitan dengansemakin bertambahnya elektron pada kulit 3d, maka semakin besar pula gaya tarik intinya, Sehingga jarak elektron pada kulit terluar ke inti semakin kecil.
- Energi ionisasi cenderung bertambah dari Sc ke Zn. Walaupun terjadi sedikit fluktuatif, namun secara umum Ionization Energy (IE) meningkat dari Sc ke Zn. Kalau kita perhatikan, ada sesuatu hal yang unik terjadi pada pengisian elektron pada logam transisi. Setelah pengisian elektron pada subkulit 3s dan 3p, pengisian dilanjutkan ke kulit 4s tidak langsung ke 3d, sehingga kalium dan kalsium terlebih dahulu dibanding Sc. Hal ini berdampak pada grafik energi ionisasinya yang fluktuatif dan selisih nilai energi ionisasi antar atom yang berurutan tidak terlalu besar. Karena ketika logam menjadi ion, maka elektron pada kulit 4s lah yang terlebih dahulu terionisasi.
3. Konfigurasi elektron
Kecuali unsur Cr dan Cu, semua unsur transisi periode keempat mempunyai elektron pada kulit terluar 4s2, sedangkan pada Cr dan Cu adalah 4s1.
Senyawa-senyawa unsur transisi di alam ternyata mempunyai bilangan oksidasi lebih dari satu. Adanya bilangan oksidasi lebih dari satu ini disebabkan mudahnya melepaskan elektron valensi. Dengan demikian, energi ionisasi pertama, kedua dan seterusnya memiliki harga yang relatif lebih kecil dibanding unsur golongan utama.
Walaupun unsur transisi memiliki beberapa bilangan oksidasi, keteraturan dapat dikenali. Bilangan oksidasi tertinggi atom yang memiliki lima elektron yakni jumlah orbital d berkaitan dengan keadaan saat semua elektron d (selain elektron s) dikeluarkan. Jadi, dalam kasus skandium dengan konfigurasi elektron (n-1)d1ns2, bilangan oksidasinya 3. Mangan dengan konfigurasi (n-1)d5ns2, akan berbilangan oksidasi maksimum +7.
Bila jumlah elektron d melebihi 5, situasinya berubah. Untuk besi Fe dengan konfigurasi elektron (n-1)d6ns2, bilangan oksidasi utamanya adalah +2 dan +3. Sangat jarang ditemui bilangan oksidasi +6. Bilangan oksidasi tertinggi sejumlah logam transisi penting seperti kobal Co, Nikel Ni, tembaga Cu dan zink Zn lebih rendah dari bilangan oksidasi atom yang kehilangan semua elektron (n–1)d dan ns-nya. Di antara unsur-unsur yang ada dalam golongan yang sama, semakin tinggi bilangan oksidasi semakin penting untuk unsur-unsur pada periode yang lebih besar.


Sifat sifat yang lain seperti kemagnetan, warna ion dan senyawa, dan sifat katalitik akan dijelaskan secara terperinci pada halaman lain.
Sebagian besar logam terdapat di alam dalam bentuk senyawa. Hanya sebagian kecil terdapat dalam keadaan bebas seperti emas, perak dan sedikit tembaga. Pada umumnya terdapat dalam bentuk senyawa sulfida dan oksida, karena senyawa ini sukar larut dalam air. Contohnya : Fe2O3, Cu2S, NiS, ZnS, MnO2.
Pengolahan logam dari bijih disebutmetalurgi. Bijih adalah mineral atau benda alam lainnya yang secara ekonomis dapat diambil logamnya. Karena logam banyak terdapat dalam bentuk senyawa (oksida, sulfida), maka prosesnya selalu reduksi.
Ada tiga tingkat proses pengolahan, yaitu :
1. Menaikan konsentrasi bijih.
2. proses reduksi
3. Pembersihan, pembuatan aliase dan pemurnian
1. Menaikan Konsentrasi Bijih.
Memisahkan bijih dari campurannya misalnya dengan ditumbuk, lalu dipisahkan dengan berbagai cara, misalnya :
a. Dicuci dengan air.
b. Diapungkan dengan deterjen atau zat pembuih (flotasi)
c. Dipisahkan dengan magnet
d. Dengan pemanggangan. Bijih dipanaskan di udara terbuka, menghasilkan oksidanya.
e. Dilarutkan sehingga terbentuk senyawa kompleks
2. Proses Reduksi
Umumnya menggunakan reduktor yang murah yaitu karbon (kokes). Untuk logam yang reaktif digunakan reduktor yang lebih kuat seperti hidrogen, logam alkali tanah dan alumunium. Logam-logam yang sangat reaktif dilakukan reduksi elektrolisis (reduksi katodik)
a. Reduksi dengan karbon (C) :
b. Reduksi dengan logam yang lebih reaktif :
3. Proses Pemurnian (refining)
Dengan proses-proses peleburan, destilasi atau dengan elektrolisis. Proses peleburan misalnya untuk memperoleh tembaga 99% untuk membuat baja dan sebagainya. Untuk memperoleh tembaga yang murni untuk keperluan teknik listrik dilakukan dengan elektrolisis. Dengan destilasi misalnya pada pembuatan air raksa dan seng. Berikut ikhtisar mineral dan cara memperoleh logam transisi periode 4.
Tabel 55.1 Mineral dan cara memperoleh logam transisi periode keempat.
Unsur | Bijih/mineral | Senyawa yang direduksi | Pereduksi | Keterangan |
Sc | Tidak dibuat dalam skala industri | |||
Ti | Rutile, TiO2 | TiCl4 | Mg atau Na | |
V | Carnolite, V2O5 | V2O5 | Al | |
Cr | Chromite, FeCr2O4 | Na2Cr2O7 | C lalu Al | |
Mn | Pyrolucite, MnO2 | Mn3O4 | Al | |
Fe | Haematite, Fe2O3 | Fe2O3 | C atau CO | Dapur tinggi |
Magnetite, Fe3O4 | ||||
Co | Cobaltite, Co As S | Co3O4 | Al | |
Ni | Millerite, NiS | NiO | C | |
Cu | Copper glance, CuS | Cu2S | S* | |
Zn | Zink blende, ZnS | ZnO | C(CO) | Dapur tinggi |
B. BESI DIEKSTRAKSI DARI OKSIDA BESI DENGAN REDUKTOR KARBON
PENGOLAHAN BESI BAJA
Bahan dasar : Bijih besi hematit Fe2O3, magnetit Fe3O4, bahan tambahan batu gamping, CaCO3 atau pasir (SiO2). Reduktor kokes (C)
Dasar reaksi : Reduksi dengan gas CO, dari pembakaran tak sempurna C
Tempat : Dapur tinggi (tanur tinggi), yang dindingnya terbuat dari batu tahan api.
Gb.55.1. Dapur Tinggi
Reaksi dalam dapur tinggi adalah kompleks. Secara sederhana dapat dilihat pada penjelasan berikut. Dalam 24 jam rata-rata menghasilkan 1.000 – 2.000 ton besi kasar dan 500 ton kerak (terutama CaSiO3). Kira-kira 2 ton bijih, 1 ton kokes dan 0,3 ton gamping dapat menghasilkan 1 ton besi kasar.
Reaksi yang terjadi :
1. Reaksi pembakaran.
Udara yang panas dihembuskan , membakar karbon terjadi gas CO2 dan panas. Gas CO2yang naik direduksi oleh C menjadi gas CO.
2. Proses reduksi
Gas CO mereduksi bijih.
Besi yang terjadi bersatu dengan C, kemudian mleleh karena suhu tinggi (1.5000C)
3. Reaksi pembentukan kerak
pasir
Karena suhu yang tinggi baik besi maupun kerak mencair. Besi cair berada di bawah. Kemudian dikeluarkan melalui lubang bawah, diperoleh besi kasar dengan kadar C hingga 4,5%. Disamping C mengandung sedikit S, P, Si dan Mn. Besi kasar yang diperoleh keras tetapi sangat rapuh lalu diproses lagi untuk membuat baja dengan kadar C sebagai berikut :
baja ringan kadar C : 0,05 – 0,2 %
baja medium kadar C : 0,2 – 0,7 %
baja keras kadar C : 0,7 – 1,6 %
Pembuatan baja :
Dibuat dari besi kasar dengan prinsip mengurangi kadar C dan unsur-unsur campuran yang lain. Ada 3 cara :
1. Proses Bessemer :
Besi kasar dibakar dalam alat convertor Bessemer. Dari lubang-lubang bawah dihembuskan udara panas sehingga C dan unsur-unsur lain terbakar dan keluar gas. Setelah beberapa waktu kira-kira ¼ jam dihentikan lalu dituang dan dicetak.
2. Open-hearth process
Besi kasar, besi tua dan bijih dibakar dalam alat open-hearth. Oksida-oksida besi (besi tua, bijih) bereaksi dengan C dan unsur-unsur lain Si, P, Mn terjadi besi dan oksida-oksida SiO2, P2O5, MnO2 dan CO2. dengan demikian kadar C berkurang.
3. Dengan dapur listrik.
Untuk memperoleh baja yang baik, maka pemanasan dilakukan dalam dapur listrik. Hingga pembakaran dapat dikontrol sehingga terjadi besi dengan kadar C yang tertentu.
C. EKSTRAKSI TEMBAGA DARI BIJIHNYA DILAUKAN MELALUI RANGKAIAN REAKSI REDOKS.
Pengolahan tembaga
Tembaga terdapat di alam dalam bentuk senyawa Cu2S, Cu2O. Bijih tembaga dinaikan konsentrasinya dengan proses pengapungan (flotasi) lalu dikenakan proses pemanggangan. Maka terjadi proses reduksi intramolekuler, diperoleh tembaga.
Reaksinya :
Cu2S + O2 2 Cu + SO2
2 Cu2S + 3 O2 2 Cu2O + 2 SO2
Cu2S + 2 Cu2O 6 Cu + SO2
Tembaga yang diperoleh belum murni tetapi sudah dapat digunakan untuk berbagai keperluan seperti pipa, bejana, dan lain-lain, tetapi belum baik untuk penghantar listrik. Untuk memurnikan dilakukan proses elektrolis.
Proses pemurnian tembaga :
Susunan : - Katode : logam Cu dilapis tipis dengan karbon grafit.
- Anode : logam Cu tak murni
- Elektrolit : larutan CuSO4
Anode : Cu (An) Cu+2 + 2e-
Yang dapat tereduksi pada katode hanya Cu, sedang logam yang kurang reaktif (Ag, Au) mengendap di dasar bejana, dan logam yang lebih reaktif (Fe) tetap dalam larutan, sebagai ion Fe2+, Ag dan Au merupakan hasil tambahan.






 15:45
15:45
 Unknown
Unknown


 Posted in:
Posted in: 

1 comments:
This is a very informative explanation of the properties and characteristics of transition metals.
Post a Comment