Berikut ini salah satu upaya pengelompokan unsur dari para ilmuwan:
1. Ahli kimia yang bersal dari Arab dan Persia
Para ahli kimia yang berasal dari arab dan persia pada awalnya mengelompokkan zat-zat berdasarkan sifat logam dan non logam.
Berikut ini ditampilkan tabel Sifat logam dan non logam
Sifat logam Sifat non logam
Mengkilap
Umumnya berupa padatan pada suhu kamar
Mudah ditempa /dibentuk
Penghantar panas yang baik Tidak mengkilap
Dapat brupa padaan, cair, dan gas pada suhu kamar
Sulit dibentuk dan rapuh
Buka penghantar panas yang baik
2. Antoine Lavoiseir
Lavoiseir mengelompokkan unsur-unsur berdasarkan pada sifat kimia yaitu : gas, non logam, logam dan tanah
3. John Dalton
Dalton mengelompokkan unsur-unsur yang jumlahnya 36 unsur (pada waktu itu diketahui 36 unsur) berdasarkan kenaikan massa atonya. Hal ini berdaarkan pada teorinya yang mnyatkan bahwa unsur dari atom yang bebeda mempunyai sifat dan massa atom yang berbeda pula, Masa atom tersebut adalah perbandingan assa atom unsur terhadap massa atom unsur hidrogen.
4. Jons Jacob Berzelius
Para ilmuwan pada waktu itu menemukan kesalahan yang dialkukan olh dalton yaitu pada pengukuran unsur Oksigen yang seharusnya massanya 16 kali massa hidrogen tetapi Dalton menghitung massa oksigen yatu, 7 kali massa hidrogen. Selanjutnya Berzelius berhasil membuat dan mempublikasikan daftar massa atom unsur-unsur dengan akurat. Dari daftar tersebut para ilmuwan yang lain berusaha mengelompokkan unsur-unsur berdsarkan pada hubungan antara sifat dan massa atom unsur.
Berikut ini pengelompokkan unsur berdsarkan pada kemiripan sifat-sifatnya dan melihat adanya hubungan antara sifat dan massa atom unsur
1. Triad Dobereiner
Pada tahun 1829 Dobereiner mengelompokkan unsur-unsur berdasarkan kemiripan sifat-sifatnya. Tiap kelompok terdiri dari 3 unsur, sehingga pengelompokan yang dilakukannya dinamakan dengan triad Dobereiner. Di dalam triad, unsur ke-2 mempunyai sifat yang berada diantara sifat unsur ke-1 dan ke-3.
Sebagai contoh, triad yan terdiri dari unsur lithium (li) dengan no massa 7, natrium dengan no massa 23, dan kalium dengan no massa 39. Ketiga unsur trebut mempunyai kemiripan sifat seperti ditampilkan pada tabel berikut :
Sifat Li, Na dan K | Keterangan |
Tampak Titik leleh Titik didih Kerapatan Kereaktifan | Merupakan logam mengkilap tapi lunak Rendah dibandingkan logam Rendah dibandingkan logam Rendah dan terapung di air Dapat bereaksi secara hebat dengan air |
Selain itu Dobereiner juga menemukan bahwa ternyata masa unsur ke-2 merupan rata-rata dari unsur ke-1 dam ke-3, hal ini terlihat dari massa Na yaitu :
Massa Na =
=
= 23
2. Oktaf Newland
Pada tahun 1865, mengelompokkan unsur-unsur berdasarkan pada kenaikan massa atom, namun dari sifat-sifat unsur tersebut ia memgamati adanya pengulangan atau keperiodikan sifat unsur. Sifat unsur yang ke 8 mirip dengan sifat unsur yang ke-1, demikian seterusnya sifat unsur ke-9 memiliki sifat yang mirip dngan unsur ke-2. Karena terjadi pengulangan sifat seperti itu, maka hal trsebut disebut dengan Hukum Oktaf. Berikut ini tabel hukumoktaf :
Do 1 | Re 2 | Mi 3 | Fa 4 | Sol 5 | La 6 | Si 7 |
H | LI | Be | B | C | N | O |
F | NA | Mg | Al | Si | P | S |
Cl | K | Ca | Cr | Ti | Mn | Fe |
Co,Ni | Cu | Zn | Y | In | As | Se |
Br | Rb | Sr | Ce,La | Zr | Di, Mo | Ro, Ru |
Pd | Ag | Cd | U | Sn | Sb | I |
Te | Cs | Ba | Ta | W | Nb | Au |
Pt, Ir | Os | V | Tl | Pb | Bi | Th |
3. Sistem Periodik meyer
Pada tahun 1864, Lothar Meyer melakukan eksperimen yaitu mengamati hubungan antara kenaikan massa atom denan sifat unsur. Hal tersebut dilakukan dengan membuat kurva volume atom versus massa atom atom, grafik tersebut ditampilakna di bawah ini :
Dari grafik tersebut, ia melihat adanya keteraturan pada unsur-unsur dengan sifat yang mirip. Sebagai contoh, lithium (Li), Natrium (Na), Kalium (K), dan Rubidium (Rb) berada pada puncak. Yang lebih penting adalah ia mengamti jumlah unsur-unsur diantara puncak-puncak tersebut berbeda-beda. Dengan demkian, pengulangan pada hukum oktaf tidak berlaku.
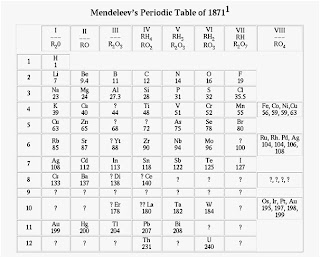
1. Sistem Periodik Mendeleev
Ahli kima yang berasal dari Rusia yaitu Dmitri Mendeleev pada awalnya mencoba mengelompokkan unsur-unsur denga mencari informasi sebanyak mungkin tentang unsur tersebut. Ia juga senang bermain kartu, selanjutnya ia menuliskan nama serta massa atom dari setiap unsur pada kartu, dan ia menyusun kartu-kartu unsur tersebut menurut kenaikan nomor atomnya.
Dari kartu unsur yang ia buat, ia melihat adanya pengulangan sifat unsur. Berdasarkan hal tersebut ia mencoba membuat pengelompokan dan mengamati hal-hal yang tak terduga. Kartu – kartu unsur dengan sifat yang mirip terletak pada kolom yang sama, sebagai contoh unsur Na dan K merupakan logam yang reaktif, menempati kolom yang sama. Demikian pula halnya dengan unsur F dan Cl adalah non-logam yang sangat reaktif.
Dari pengamatan yang ia lakukan, pada tahun 1869 Mendeleev membuat sistem periodiknya yang pertama. Ia mengelopokkan unsur-unsur berdasarkan kenaikan nomor atom dan kemiripan sifat dari unsur. Unsur-unsur yang memiliki sifat yang mirip ditempatkan pada kolom yang disebut dengn golongan, sedangkan pengulangan sifat akan berada dala 1 baris selanjutnya disebut dengan periode.
Pada tahun 1871 ia menyempurnakan sistem periodik yang telah ia buat, sistem periodik tersebut ditampilkan pada gambar di bawah ini :
Seperti telah dijelaskan Sisem Periodik Modern adalah menyempurnakan sistem periodik yang telah disusun oleh Mendeleev, Kemiripan sifat dari unsur-unsur dala golonan terlkait dengan konfigurasi elektron dari unsur tersebut, selain itu juga ternyata unsur-unsur dalam satu golongan memiliki elektron valensi yang sama. Berikut ini gambar sistem periodik modern






 21:05
21:05
 Unknown
Unknown





 Posted in:
Posted in: 

0 comments:
Post a Comment